مخطط الموضوع
عام
Présenté par: Dr.K.Ammiali
Maître Assistant classe B, Département de Physique Université Badji Mokhtar Annaba
Informations sur le cours
Faculté: Sciences
Département: Physique
Public cible : 2ème Année sciences de la vie
Intitulé du cours : Biophysique
Crédit:05
Coefficient:03
Durée : 13 semaines ( 15h )
contact
Dr. K.Ammiali
Laboratoire des semi-conducteurs- Département de physique- faculté des sciences
E-mail: k_ammiali@yahoo.fr

Objectifs du cours
- Bien connaitre les lois de la thermodynamique reliées aux gaz
- Connaitre la structure de base de la matière (système cubique) et ces différentes lois
- Connaitre les composants d’une solution, savoir ce qui est une solution aqueuse, connaitre les différentes concentrations possible
-Etudier les caractéristiques de différentes interface : liquide /gaz, liquide/liquide, liquide/solide
Connaissances préalables
Biophysique
Chapitre 1: Généralités sur les gaz
La thermodynamique est la branche de la physique qui traite de la dépendance des propriétés physiques des corps à la température, des phénomènes où interviennent des échanges thermiques, et des transformations de l'énergie entre différentes formes. La thermodynamique peut être abordée selon deux approches différentes et complémentaires : phénoménologique et statistique.
La thermodynamique phénoménologique ou classique a été l'objet de nombreuses avancées dès le xviie siècle. Elle s'appuie sur des considérations macroscopiques pour établir un nombre réduit de principes et de lois, issus d'observations expérimentales.La thermodynamique statistique, qui s'est développée à partir du milieu du xixe siècle, s'appuie quant à elle sur des considérations moléculaires et sur le calcul des probabilités appliqué à un grand nombre de particules. Elle s'attache à analyser la structure de la matière et à établir un lien entre ses propriétés et les principes de la thermodynamique phénoménologique.
L'étude des gaz parfaits et celle des machines thermiques, qui échangent de l'énergie avec l'extérieur sous forme de travail et de chaleur, occupent une place centrale dans la thermodynamique : elles ont permis le développement de très nombreuses machines et méthodes industrielles, et servi de base à d'importantes découvertes en chimie1, en astrophysique2 et dans de nombreux autres domaines scientifiques.
Chapitre 2: La cristallographie
Par structure cristalline on entend l'arrangement des atomes dans un cristal. Un cristal est défini comme étant un corps solide qui a une structure réticulaire et se composant d'atomes (ions) répartis suivant une succession déterminée qui se produit périodiquement dans les trois dimensions. L'absence de structure réticulaire caractérise le corps amorphe. Les propriétés des corps amorphes diffèrent largement de celle des corps cristallin. Les corps amorphes sont caractérisés par la disposition chaotique de leurs atomes ce qui donne une structure interne désordonnée (comme un liquide). Un corps amorphe n'a pas de forme géométrique naturelle, ils sont assimilés à des liquides figés. Les corps amorphes sont caractérisés par:
- L'absence d'une température de fusion nettement déterminée.
- L'isotropie (mêmes propriétés dans les différentes directions) surtout les propriétés
physiques.
On trouve ainsi une différence caractéristique dans les courbes de refroidissement des
corps amorphes et cristallins, le refroidissement des corps amorphes se traduit par une courbe
décroissante et continue, Tandis que celui des corps cristallins présente un palier en température qui marque le début et fin de solidification (cristallisation) les corps cristallins sont caractérisés par les propriétés suivantes :
a. Ils sont caractérisés par tune certaine anisotropie (les propriétés physiques ne sont pas les mêmes dans les différentes directions), l'anisotropie peut être constatée à l'échelle macro et microscopique.
b. Un matériau cristallin peut présenter soit :
- Un monocristal (cristal unique) par exemple le cristal de quartz, de calat, de diamant etc.
- Un polycristal ou une agglomération de petits cristaux (échantillon d'acier).
c. Les cristaux sont caractérises par des faces planes, des arêtes rectilignes et des
sommets tels : F + S = A + 2
F : faces, S : sommets, A : arêtes.
Les faces sont caractérisées pat deux lois :Si l'on rapporte les différentes faces d'un cristal à un système de coordonnées à 3 dimensions, la position dune face quelconque peut toujours être exprimée par trois nombres entiers simples. Si on fait intervenir la notion de réseau tridimensionnel, la position de tout point du réseau peut être indiquée par des coordonnées par rapport à un système d'axes dont l'origine est placée en nu noeud du réseau Un point quelconque A est définit par le vecteur OA:
OA = p.a + q.b + r.c avec p, q, r : entiers
d. Constante des angles dièdres l'angle formé par deux faces déterminées est constant
dans tous les cristaux d'une même espèce chimique. Si nous coupons un cristal de
quartz perpendiculairement à l'axe vertical, on obtient plusieurs configurations mais avec des angles rigoureusement égaux à 120°,
e. La plupart des cristaux se comportent dune façon inattendue par rapport à la lumière.
Les rayons lumineux se propagent à des vitesses différentes dans les milieux
cristallins.
f. Les propriétés d'un cristal peuvent avoir la même valeur dans plusieurs directions et l'on décèle suivant ces directions une symétrie de diverses natures.

Chapitre 3: Les solutions
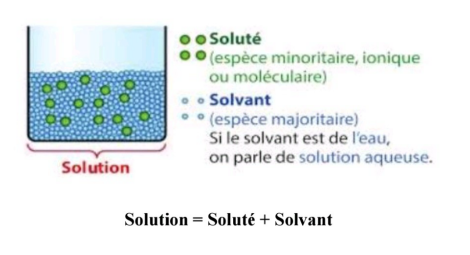
Une solution, en chimie, est un mélange homogène (constitué d'une seule phase) résultant de la dissolution d'un ou plusieurs soluté(s) (espèce chimique dissoute) dans un solvant. Les molécules (ou les ions) de soluté sont alors solvatées et dispersées dans le solvant. En chimie, une solution aqueuse est une phase liquide contenant plusieurs espèces chimiques, dont une ultramajoritaire, l'eau (H2O, le solvant), et des espèces ultraminoritaires, les solutés ou « espèces chimiques dissoutes ».
Chapitre 4: Les états de surfaces
L'étude des états de surfaces a une importance particulière car tout corps liquide ou solide, interagit avec le milieu ambiant à travers sa partie extérieure, c-à-d la surface qui le délimite. Tous les phénomènes de surface que se soit en phase solide ou liquide sont une conséquence directe des forces de cohésion inter-atomiques ou inter-moléculaires. Les atomes se trouvant à la surface d'un solide ou d'un liquide (dont l'épaisseur ne dépasse pas une vingtaine d'Angström) présentent une coordinence moins complète que ceux situés au cœur du système . Ces atomes vont conférer à la surface, des propriétés tout à fait particulières et leurs études jouent un grand rôle dans plusieurs domaines.
Bibliographie
Cours Biophysique, Université Badji Mokhtar-Annaba-,Présenté par : Prof. A. Ainsouya,
Cours de biophysique des solutions (1 ère année médecine : 2022/2023) Présenté par : Dr. N. GUECHI
Biophysique des solutions, université de Batna, Faculté de Medcine, présenté par: N.CHERIET
EXERCICES ET PROBLEMES CORRIGES DE THERMODYNAMIQUE CHIMIQUE», Réalisé par les professeurs : NABIH Khadija, RHALIB KNIAZEVA Albina, CHERKAOUI EL MOURSLI Fouzia
Module de Biophysique , TD 4 : Les Phénomènes de Surfaces (2 Séance), Université Frères Mentouri Constantine1, Faculté des Sciences de la Nature et de la Vie, 2eme Année Tronc Commun LMD

EXAME FINAL
Déposer ici la solution
